Как гомеопатия работает в лечении рака: глубокое понимание клинических и экспериментальных исследований.

Renu Yadav, Babban Jee, Krs Sambasiva Rao. (2019). How Homeopathic Medicine Works in Cancer Treatment: Deep Insight From Clinical to Experimental Studies // J Exp Ther Oncol. 2019 Jan;13(1):71-76. Аннотация Среди всех комплементарных направлений медицины гомеопатия является самой популярной во всем мире. Несмотря на то, что продолжаются долгие споры о том, является ли эффекты гомеопатии просто плацебо или нет, гомеопатия считается безопасной и экономически целесообразным методом лечения. Ряд заболеваний человека, от общих до серьезных, лечили гомеопатией. Тем не менее, подбор соответствующих лекарств против болезни является сложной задачей, так как необходимо учесть полный спектр симптомов пациента. Имеющиеся данные свидетельствуют о том, что гомеопатия обладает потенциалом не только для лечения различных видов рака, но и для уменьшения побочных эффектов, вызываемых стандартными терапевтическими методами, такими как химиотерапия, лучевая терапия или хирургическое вмешательство. Хотя гомеопатия широко используется для лечения рака, ее эффективность все еще находится под вопросом. В настоящем обзоре обсуждается противораковое действие различных гомеопатических лекарств против различных видов рака и также предлагается дальнейший курс исследований. Вступление Гомеопатия-это много вековая терапевтическая система, практикуемая как часть комплементарной и альтернативной медицины (CAM). Эта альтернативная система терапии была разработана известным немецким врачом Самуэлем Ганеманом (1755-1843) в 1796 году. После своего изобретения гомеопатия стала предметом больших споров, и во многих случаях ее эффективность подвергалась сомнению. Есть целый ряд публикаций, в которых которых считается эффекты гомеопатии просто плацебо. [1-4]. Однако имеются также многочисленные убедительные доказательства его эффективности в лечении многих серьезных заболеваний человека, включая хронические респираторные заболевания, такие как астма, обструктивная болезнь легких [5], тяжелый сепсис [6], грипп и гриппоподобный синдром [7], синдром раздраженного кишечника [8] и фибромиалгию [9]. Независимо от того, является ли гомеопатия чем-то, этот способ лечения был одобрен всем миром. В ряде стран, включая Бразилию, Англию, США и Индию, гомеопатия была принята как устоявшаяся система терапии [10, 11]. Также в Германии, где она была открыта, большая часть населения использует гомеопатические препараты [12]. Гомеопатия работает на трех основных фундаментальных принципах, которые включают (I) «подобное лечится подобным», постулирующего, что если лекарство вызывает симптомы у здоровых людей, то же лекарство может использоваться, чтобы лечить этот симптомы у пациента, (II) и «память воды», в котором гомеопатический препарат сохраняет свои биологические свойства после последовательных разбавлений, даже при разведениях выходящих за число Авогадро и (III) три миазма — псора, сикоз и Люис — источники происхождения всех болезней [13]. За время развития с 19-го века до 21-го века весь мир претерпел много изменений, но эти фундаментальные принципы гомеопатии остались нетронутыми. Выбор того или иного лекарственного средства практикующим врачом для лечения больного зависит от общего спектра симптомов пациентов, И в связи с этим гомеопатия считается самым комплексным и целостным подходом терапии для лечения любого заболевания человека [1]. Рак-это серьезное опасное для жизни клеточное заболевание. Сегодня весь мир находится в его власти. По оценкам недавно опубликованного доклада, в 2015 году только из-за рака произошло около 8,8 миллиона смертей. Кроме того, было зарегистрировано около 14 миллионов новых случаев заболевания раком. Из-за этого рак стал второй ведущей причиной смертности и заболеваемости во всем мире [14]. Лучевая терапия, хирургия и химиотерапия являются основой лечения рака во всем мире. Однако эти методы имеют много недостатков, которые включают целый ряд серьезных долгосрочных побочных эффектов, таких как кардиотоксичность, нарушение функции легких, гипертония, когнитивные нарушения, нарушение фертильности, кровоизлияния, перфорация желудочно-кишечного тракта, замедленное заживление ран, миелосупрессия, кожная токсичность, электролитный дисбаланс, сексуальные аномалии и периферическая невропатия [15-18]. Следовательно, необходим безопасный вариант лечения. Гомеопатия удовлетворяет эту насущную потребность, и в связи с этим она была принята в качестве одного из семи методов CAM лечения рака[19]. Все больше доказательств свидетельствует о том, что при ряде онкологических болезней срок дожития пациентов значительно увеличивался ряд после гомеопатического лечения [20, 21], хотя способ действия гомеопатических препаратов, используемых в лечении рака, до сих пор остается неясным. В настоящем обзоре обсуждается противоопухолевый эффект гомеопатических препаратов против различных видов рака, а также предлагается будущий курс действий. Гомеопатические лекарства, используемые в лечении рака Основные гомеопатические препараты, которые используются для лечения рака или тестируются на различных моделях рака, перечислены в таблице 1.
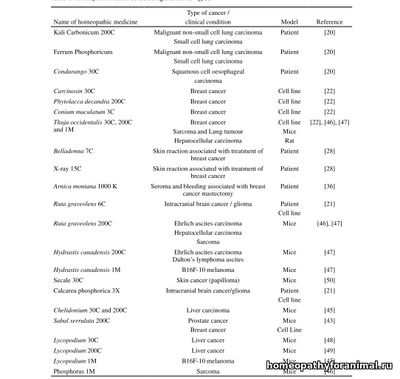
Эффективность гомеопатических лекарств у онкологических пациентов До настоящего времени было проведено очень мало клинических исследований для оценки эффективности гомеопатии в лечении рака. Среди исследований, проведенных в Индии Фондом гомеопатических исследований им. П. Банерджи (PBHRF), Калькутта, использую собственный разработанный протокол (протокол Банерджи), показали наиболее значительные результаты, поскольку результаты этого исследования позволяют предположить, что гомеопатические препараты, а именно Carcinosin (30C) и Phytolacca decandra (200C) вызывал регресс в 19% случаев опухолей, в то время как 21% опухолей были стабильными или улучшались при лечении, в течение 10 лет наблюдения [20]. Результаты этого клинического исследования были дополнительно перекрестно проверены Национальным институтом рака США (NCI). После научного исследования NCI подтвердил эффективность гомеопатических препаратов, используемых PBHRFв лечении различных видов рака [22]. Было обнаружено, что другое гомеопатическое лекарство Ruta 6 является очень эффективным при лечении пациентов, страдающих от рака головного мозга, при использовании в сочетании с Ca3 (PO4) 2. Из 9 пациентов с глиомой, получавших эту комбинированную терапию, 8 пациентов были полностью вылечены от опухоли, а у остальных пациентов отмечалось частичное выздоровление. В других группах больных раком эта комбинированная терапия оказалась эффективной для ограничения прогрессирования опухоли [21]. Не только в Индии, во многих других европейских и средиземноморских странах, включая Англию, Уэльс, Северную Ирландию, Италию, Израиль гомеопатия использовалась для лечения онкологических пациентов с раком молочной железы, раком кишечника, раком легкого, раком яичников / эндометрия [23-27] или при лечении побочных эффектов, вызванных стандартным лечением рака, таким как химиотерапия / лучевая терапия / хирургия [ 28-36]. Напротив, систематический обзор, основанный на пяти рандомизированных контролируемых исследованиях (РКИ) и одном нерандомизированном клиническом контролируемом исследовании (ЦКТ), ставит под сомнение эффективность различных гомеопатических лекарств в лечении рака [37]. Тем не менее, в этом обзоре четко указывалось, что клинические испытания, на основании которых был сделан такой вывод, имели несколько недостатков и предлагая дальнейшие исследования для строгой проверки эффективности этой альтернативной системы на большой популяции больных раком с использованием установленных протоколов клинических испытаний [37]. Модели экспериментального рака Модели рака у животных За последние два десятилетия было проведено ограниченное количество исследований на животных, чтобы подтвердить эффективность гомеопатических лекарств против некоторых отдельных видов рака (Таблица 1). Тем не менее, их выводы не были значительными с точки зрения лечения, чтобы можно сделать какой-либо существенный вывод. Но с исследовательской точки зрения знания по этому аспекту, безусловно, были передовыми. В этом контексте исследование, проведенное Моффетом и его коллегами в 2003 году на мышах, в которых клетки меланомы были инъецированы для индукции рака, показало, что гомеопатический препарат Thuja occidentalis (1M) не способен контролировать прогрессирование опухоли легких у экспериментальных мышей [38]. ]. Но его фракции (α / β-туйон) были эффективны в ограничении прогрессирования глиобластомы in vivo. Фракции туи также подавляли экспрессию генов VEGF, Ang-4 и CD31 в раковых клетках [39]. Напротив, другая группа обнаружила, что гомеопатические препараты Conium maculatum, Thuja occidentalis, Sabal serrulata и Carcinosin были очень эффективными в замедлении прогрессирования онкогенеза и уменьшении метастазов, объема опухоли и веса опухоли у крыс, которым привили клетки рака простаты MAT-LyLu [40, 41]. Аналогичные результаты были получены в других исследованиях рака предстательной железы in vivo, проведенных на крысах [42] или на голых мышах [43], что позволило получить экспериментальные данные о противораковых свойствах гомеопатических препаратов. Установлено, что гомеопатический препарат M1 ингибирует развитие меланомы и метастазирования у мышей C57BL / 6, которым инъецированы клетки меланомы мыши B16F10 [44]. Кроме того, потенцированные гомеопатические составы также показали свою эффективность в предотвращении химически индуцированной гепатоцеллюлярной карциномы и саркомы на экспериментальных животных моделях. Когда некоторые выбранные потенции Chelidonium использовались для лечения p-DAB-индуцированной гепатокарциномы у инбредного штамма мышей , наблюдалось уменьшение развития опухоли примерно на 40% [45]. Использование Ruta, Hydrastis, Lycopodium, Thuja и Фосфора 1M животным, страдающим химически индуцированным раком, замедляло рост опухоли и связанную с ней патологию. Кроме того, было установлено, что эти гомеопатические препараты увеличивают продолжительность жизни раковых животных [46]. В другом исследовании та же индийская группа исследовала противоопухолевые и антиметастатические свойства Ruta и Hydrastis, используя модель рака мышей. Полученные результаты были многообещающими, поскольку было обнаружено, что применение Ruta graveolens (200C) и Hydrastis canadensis (200C) для выживших после рака мышей значительно увеличивает продолжительность жизни животных. Кроме того, эти препараты были эффективны в подавлении роста рака, а также объема опухоли у мышей [47]. Гомеопатическое лекарство Lycopodium также обладает способностью модулировать активность некоторых важных ферментов, связанных с гепатоцеллюлярной дисфункцией во время химически индуцированного гепатокарциногенеза у мышей [48,49]. Имеющиеся экспериментальные данные свидетельствуют о том, что гомеопатические лекарственные средства опосредуют их противораковый эффект либо путем индукции механизмов апоптоза, ключевого процесса, который регулирует судьбу рака у хозяина [50- 52], либо путем модулирования иммунных ответов хозяина [53, 54]. Исследования на культурах клеток По сравнению с клиническими исследованиями и исследованиями in vivo была проведена значительная работа по выяснению механизма действия гомеопатических лекарств против различных видов рака с использованием подхода in vitro / ex vivo. Однако во всех исследованиях, которые проводились до настоящего времени, хорошо наблюдалось влияние гомеопатических лекарств на (i) жизнеспособность линий раковых клеток (ii) апоптоз или его механизм (iii) остановку клеточного цикла раковых клеточных линий и (iv) иммунную систему [21, 22, 39, 41-43, 55-58]. Одно исследование, включающее полное исследование всех генов клеток HeLa, обработанных гомеопатическим лекарством, показало, что гомеопатическое лекарственное средство модулирует экспрессию 6024 генов клеток HeLa in vitro по сравнению с плацебо, предполагая, что гомеопатическое лекарственное средство обладает эффектом отличным от плацебо [59]. Недавно группа исследовала терапевтическую эффективность нозода ВИЧ против клеточных линий рака легких [60]. Но, к сожалению, нет ни одного общедоступного исследования, которое могло бы определить полный механизм действия гомеопатического лекарства против специфического рака на молекулярном или клеточном уровне. Было также отмечено, что исследователи в этой области работали в разных направлениях и не были сосредоточены на одном. Было замечено большое различие в дизайне исследований и исследовательском подходе. Вывод На сегодняшний момент существует острая необходимость в получении существенных научных доказательств (которые можно было бы воспроизвести) об эффективности каждого гомеопатического лекарства против конкретного заболевания / клинического состояния человека с использованием всех трех доступных моделей, т.е. клинической, экспериментальных на животных и клеточных линиях. Было бы лучше, если бы внимание было сосредоточено на каскадах реакций, которые играют жизненно важную роль в канцерогенезе, а также на изучении экспрессии молекул, участвующих в этих каскадах, как на уровне генов, так и на уровне белка. Литература 1. Linde K, Clausius N, Ramirez G, Melchart D, Eitel F, Hedges LV, Jonas WB. Are the clinical effects of homeopathy placebo effects? A meta-analysis of placebo-controlled trials. Lancet 350:834-843, 1997. 2. Cucherat M, Haugh MC, Gooch M, Boissel JP. Evidence of clinical efficacy of homeopathy. A meta-analysis of clinical trials. HMRAG. Homeopathic Medicines Research Advisory Group. Eur J Clin Pharmacol 56:27-33, 2000. 3. Shang A, Huwiler-Müntener K, Nartey L, Jüni P, Dörig S, Sterne JA, Pewsner D, Egger M. Are the clinical effects of homoeopathy placebo effects? Comparative study of placebo- controlled trials of homoeopathy and allopathy. Lancet 366:726-732, 2005. 4. Reilly DT, Taylor MA, McSharry C, Aitchison T. Is homoeopathy a placebo response? Controlled trial of homoeopathic potency, with pollen in hay fever as model. Lancet 2:881-886, 1986. 5. Ullman D, Frass M. A review of homeopathic research in the treatment of respiratory allergies. Altern Med Rev 15:48-58, 2010. 6. Frass M, Linkesch M, Banyai S, Resch G, Dielacher C, Löbl T, Endler C, Haidvogl M, Muchitsch I, Schuster E. Adjunctive homeopathic treatment in patients with severe sepsis: a randomized, double-blind, placebo-controlled trial in an intensive care unit. Homeopathy 94:75-80, 2005. 7. Vickers AJ, Smith C. Homoeopathic Oscillococcinum for preventing and treating influenza and influenza-like syndromes. Cochrane Database Syst Rev 3:CD001957, 2006. 8. Peckham EJ, Nelson EA, Greenhalgh J, Cooper K, Roberts ER, Agrawal A. Homeopathy for treatment of irritable bowel syndrome. Cochrane Database Syst Rev 11:CD009710, 2013. 9. Perry R, Terry R, Ernst E. A systematic review of homoeopathy for the treatment of fibromyalgia. Clin Rheumatol 29:457-464, 2010. 10. Swayne J. International Dictionary of Homeopathy. Edinburgh: Churchill Livingstone. 2000. 11. Ernst E. Homeopathy, past present future. Br J Clin Pharmacol 44:435-437, 1997. 12. Härtel U, Volger E. Inanspruchnahme und Akzeptanz von klassischen Naturheilverfahren und alternativen Heilmethoden in Deutschland. Ergebnisse einer repräsentativen Bevölkerungsstudie. Das Gesundheitswesen 65:A35, 2003. 13. Ernst E. Homeopathy - The Undiluted Facts. Springer. 2016. 14. World Health Organization: Cancer fact sheet. http://www.who. int/mediacentre /factsheets/fs297/en/ (accessed January 7, 2018). 15. Ouwerkerk J, Boers-Doets C. Best practices in the management of toxicities related to anti-EGFR agents for metastatic colorectal cancer. Eur J Oncol Nurs 14:337-349, 2010. 16. Williams AM, Zent CS, Janelsins MC. What is known and unknown about chemotherapy-related cognitive impairment in patients with haematological malignancies and areas of needed research. Br J Haematol 174:835-846, 2016. 17. Bedoschi G, Navarro PA, Oktay K. Chemotherapy-induced damage to ovary: mechanisms and clinical impact. Future Oncol 12:2333-2344, 2016. 18. Arora N, Gupta A, Singh PP. Biological agents in gastrointestinal cancers: adverse effects and their management. J Gastrointest Oncol 8:485-498, 2017. 19. Metz JM, Jones H. Complementary and alternative medicine. In: Abeloff MD, Armitage JO, Niederhuber JE, Kastan MB, McKenna WG, eds. Abeloff’s Clinical Oncology, 4th edn. Philadelphia: Churchill Livingstone. 2008. 20. Banerji P, Campbell DR, Banerji P. Cancer patients treated with the Banerji protocols utilising homoeopathic medicine: a best case series program of the National Cancer Institute USA. Oncol Rep 20:69-74, 2008. 21. Pathak S, Multani AS, Banerji P, Banerji P. Ruta 6 selectively induces cell death in brain cancer cells but proliferation in normal peripheral blood lymphocytes: a novel treatment for human brain cancer. Int J Oncol 23:975-982, 2003. 22. Frenkel M, Mishra BM, Sen S, Yang P, Pawlus A, Vence L, Leblanc A, Cohen L, Banerji P, Banerji P. Cytotoxic effects of ultra-diluted remedies on breast cancer cells. Int J Oncol 36:395-403, 2010. 23. Hana G, Bar-Sela G, Zhana D, Mashiach T, Robinson E. The use of complementary and alternative therapies by cancer patients in northern Israel. Isr Med Assoc J 7:243-247, 2005. 24. Martel D, Bussières JF, Théorêt Y, Lebel D, Kish S, Moghrabi A, Laurier C. Use of alternative and complementary therapies in children with cancer. Pediatr Blood Cancer 44:660-668, 2005. 25. Molassiotis A, Fernadez-Ortega P, Pud D, Ozden G, Scott JA, Panteli V, Margulies A, Browall M, Magri M, Selvekerova S, Madsen E, Milovics L, Bruyns I, Gudmundsdottir G, Hummerston S, Ahmad AM, Platin N, Kearney N, Patiraki E. Use of complementary and alternative medicine in cancer patients: a European survey. Ann Oncol 16:655-663, 2005. 26. Molassiotis A, Panteli V, Patiraki E, Ozden G, Platin N, Madsen E, Browall M, Fernandez-Ortega P, Pud D, Margulies A. Complementary and alternative medicine use in lung cancer patients in eight European countries. Complement Ther Clin Pract 12:34-39, 2006. 27. Gentry-Maharaj A, Karpinskyj C, Glazer C, Burnell M, Bailey K, Apostolidou S, Ryan A, Lanceley A, Fraser L, Jacobs I, Hunter MS, Menon U. Prevalence and predictors of complementary and alternative medicine/non-pharmacological interventions use for menopausal symptoms within the UK Collaborative Trial of Ovarian Cancer Screening. Climacteric 20:240-247, 2017. 28. Balzarini A, Felisi E, Martini A, De Conno F. Efficacy of homeopathic treatment of skin reactions during radiotherapy for breast cancer: a randomised, double-blind clinical trial. Br Homeopath J 89:8-12, 2000. 29. Thompson EA, Montgomery A, Douglas D, Reilly D. A pilot, randomized, double-blinded, placebo-controlled trial of individualized homeopathy for symptoms of estrogen withdrawal in breast-cancer survivors. J Altern Complement Med 11:13-20, 2005. 30. Jacobs J, Herman P, Heron K, Olsen S, Vaughters L. Homeopathy for menopausal symptoms in breast cancer survivors: a preliminary randomized controlled trial. J Altern Complement Med 11:21-27, 2005. 31. Thompson EA, Reilly D. The homeopathic approach to the treatment of symptoms of oestrogen withdrawal in breast cancer patients. A prospective observational study. Homeopathy 92:131-134, 2003. 32. Schlappack O. Homeopathic treatment of radiation-induced itching in breast cancer patients. A prospective observational study. Homeopathy 93:210-215, 2004. 33. Pommier P, Gomez F, Sunyach MP, D’Hombres A, Carrie C, Montbarbon X. Phase III randomized trial of Calendula officinalis compared with trolamine for the prevention of acute dermatitis during irradiation for breast cancer. J Clin Oncol 22:1447-1453, 2004. 34. Rostock M, Naumann J, Guethlin C, Guenther L, Bartsch HH, Walach H. Classical homeopathy in the treatment of cancer patients - a prospective observational study of two independent cohorts. BMC Cancer 11:19, 2011. doi: 10.1186/1471-2407-11-19. 35. Samuels N, Freed Y, Weitzen R, Ben-David M, Maimon Y, Eliyahu U, Berger R. Feasibility of homeopathic treatment for symptom reduction in an integrative oncology service. Integr Cancer Ther:1534735417736133, 2017. doi: 10.1177/1534735417736133. 36. Sorrentino L, Piraneo S, Riggio E, Basilicò S, Sartani A, Bossi D, Corsi F. Is there a role for homeopathy in breast cancer surgery? A first randomized clinical trial on treatment with Arnica montana to reduce post-operative seroma and bleeding in patients undergoing total mastectomy. J Intercult Ethnopharmacol 6:1-8, 2017. 37. Milazzo S, Russell N, Ernst E. Efficacy of homeopathic therapy in cancer treatment. Eur J Cancer 42:282-289, 2006. 38. Moffett JR, Arun P, Namboodiri MA. Laboratory Research in Homeopathy: con. Integr Cancer Ther 5:333-342, 2006. 39. Torres A, Vargas Y, Uribe D, Carrasco C, Torres C, Rocha R, Oyarzún C, San Martín R, Quezada C. Pro-apoptotic and anti- angiogenic properties of the α /β-thujone fraction from Thuja occidentalis on glioblastoma cells. J Neurooncol 128:9-19, 2016. 40. Jonas WB, Gaddipati JP, Rajeshkumar NV. In vitro and in vivo assessment of homeopathic treatment for prostate cancer. Paper presented at: Society of Integrative Oncology First International Conference; November 18, 2004; New York. 41. Jonas WB, Gaddipati JP, Rajeshkumar NV, Sharma A, Thangapazham RL, Warren J, Singh AK, Ives JA, Olsen C, Mog SR, Maheshwari RK. Can homeopathic treatment slow prostate cancer growth? Integr Cancer Ther 5:343-349, 2006. 42. Thangapazham RL, Gaddipati JP, Rajeshkumar NV, Sharma A, Singh AK, Ives JA, Maheshwari RK, Jonas WB. Homeopathic medicines do not alter growth and gene expression in prostate and breast cancer cells in vitro. Integr Cancer Ther 5:356-361, 2006. 43. MacLaughlin BW, Gutsmuths B, Pretner E, Jonas WB, Ives J, Kulawardane DV, Amri H. Effects of homeopathic preparations on human prostate cancer growth in cellular and animal models. Integr Cancer Ther 5:362-372, 2006. 44. Ferrari de Andrade L, Mozeleski B, Leck AR, Rossi G, da Costa CR, de Souza Fonseca Guimarães F, Zotz R, Fialho do Nascimento K, Camargo de Oliveira C, de Freitas Buchi D, da Silva Trindade E. Inhalation therapy with M1 inhibits experimental melanoma development and metastases in mice. Homeopathy 105:109-118, 2016. 45. Biswas SJ, Khuda-Bukhsh AR. Effect of a homeopathic drug, Chelidonium, in amelioration of p-DAB induced hepatocarcinogenesis in mice. BMC Complement Altern Med 2:4, 2002. doi: 10.1186/1472-6882-2-4. 46. Kumar KB, Sunila ES, Kuttan G, Preethi KC, Venugopal CN, Kuttan R. Inhibition of chemically induced carcinogenesis by drugs used in homeopathic medicine. Asian Pac J Cancer Prev 8:98-102, 2007. 47. Sunila ES, Kuttan G, KC P, Kuttan R. Effect of homeopathic medicines on transplanted tumors in mice. Asian Pac J Cancer Prev 8:390-394, 2007. 48. Pathak S, Kumar Das J, Jyoti Biswas S, Khuda-Bukhsh AR. Protective potentials of a potentized homeopathic drug, Lycopodium-30, in ameliorating azo dye induced hepatocarcinogenesis in mice. Mol Cell Biochem 285:121-131, 2006. 49. Pathak S, Bhattacharjee N, Das JK, Choudhury SC, Karmakar SR, Banerjee P, Paul S, Banerjee A, Khuda-Bukhsh AR. Supportive evidence for the anticancerous potential of alternative medicine against hepatocarcinogenesis in mice. Forsch Komplementmed 14:148-156, 2007. 50. Khuda-Bukhsh AR, Bhattacharyya SS, Paul S, Dutta S, Boujedaini N, Belon P. Modulation of signal proteins: a plausible mechanism to explain how a potentized drug Secale Cor 30C diluted beyond Avogadro’s limit combats skin papilloma in mice. Evid Based Complement Alternat Med 2011:286320, 2011. doi: 10.1093/ecam/nep084. 51. Preethi K, Ellanghiyil S, Kuttan G, Kuttan R. Induction of apoptosis of tumor cells by some potentiated homeopathic drugs: implications on mechanism of action. Integr Cancer Ther 11:172-182, 2012. 52. Sikdar S, Mukherjee A, Bishayee K, Paul A, Saha SK, Ghosh S, Khuda-Bukhsh AR. Post-cancer treatment with Condurango 30C shows amelioration of benzo[a]pyrene-induced lung cancer in rats through the molecular pathway of caspa- se-3-mediated apoptosis induction: anti-lung cancer potential of Condurango 30C in rats. J Pharmacopuncture 16:11-22, 2013. 53. Remya V, Kuttan G. Homeopathic remedies with antineoplastic properties have immunomodulatory effects in experimental animals. Homeopathy 104:211-219, 2015. 54. Thangapazham RL, Rajeshkumar NV, Sharma A, Warren J, Singh AK, Ives JA, Gaddipati JP, Maheshwari RK, Jonas WB. Effect of homeopathic treatment on gene expression in Copenhagen rat tumor tissues. Integr Cancer Ther 5:350-355, 2006. 55. Mondal J, Samadder A, Khuda-Bukhsh AR. Psorinum 6 × triggers apoptosis signals in human lung cancer cells. J Integr Med 14:143-153, 2016. 56. Ghosh S, Bishayee K, Paul A, Mukherjee A, Sikdar S, Chakraborty D, Boujedaini N, Khuda-Bukhsh AR. Homeopathic mother tincture of Phytolacca decandra induces apoptosis in skin melanoma cells by activating caspase-mediated signaling via reactive oxygen species elevation. J Integr Med 11:116-124, 2013. 57. Bishayee K, Sikdar S, Khuda-Bukhsh AR. Evidence of an epigenetic modification in cell-cycle arrest caused by the use of ultra-highly-diluted Gonolobus Condurango extract. J Pharmacopuncture 16:7-13, 2013. 58. Saha S, Hossain DM, Mukherjee S, Mohanty S, Mazumdar M, Mukherjee S, Ghosh UK, Nayek C, Raveendar C, Khurana A, Chakrabarty R, Sa G, Das T. Calcarea carbonica induces apoptosis in cancer cells in p53-dependent manner via an immunomodulatory circuit. BMC Complement Altern Med 13:230, 2013. doi: 10.1186/1472-6882-13-230. 59. Saha SK, Roy S, Khuda-Bukhsh AR. Evidence in support of gene regulatory hypothesis: Gene expression profiling manifests homeopathy effect as more than placebo. Int J High Dilution Res 12:162-167, 2013. 60. Khuda-Bukhsh AR, Mondal J, Shah R. Therapeutic potential of HIV nosode 30c as evaluated in A549 lung cancer cells. Homeopathy 106:203-213, 2017. Источник: https://pubmed.ncbi.nlm.nih.gov/30658031/ | |
| Просмотров: 1221 | |
